Гель проникающая хроматография принцип работы. Гель-хроматография как метод определения молекулярной массы. Базовая вэжх система для гпх
Эксклюзионная хроматография представляет собой вариант жидкостной хроматографии, в котором разделение происходит за счет распределения молекул между растворителем, находящимся внутри пор сорбента, и растворителем, протекающим между его частицами, т.е. неподвижной фазой служит пористое тело или гель, а различное удерживание веществ обусловлено различия в размерах молекул веществ, их форме и способности проникать в поры неподвижной фазы. В названии метода отражен механизм процесса, от английского термина “Size Exclusion” , означающего исключение по размеру. Гель-проникающая хроматография (ГПХ) - эксклюзионная хроматография, в которой неподвижной фазой служит гель.
В отличие от остальных вариантов ВЭЖХ, где разделение идет за счет различного взаимодействия компонентов с поверхностью сорбента, роль твердого наполнителя в эксклюзионной хроматографии заключается только в формировании пор определенного размера, а неподвижной фазой является растворитель, заполняющий эти поры.
Принципиальной особенностью метода является возможность разделения молекул по их размеру в растворе в диапазоне практически любых молекулярных масс - от 10 2 до 10 8 , что делает его незаменимым для исследования синтетических высокомолекулярных веществ и биополимеров.
Рассмотрим принципиальные основы метода. Объем эксклюзионной колонки можно выразить суммой трех слагаемых:
V с = V м + V i + V d ,
где V м - мертвый объем (объем растворителя между частицами сорбента, иначе говоря, объем подвижной фазы); V i - объем пор, занятый растворителем (объем неподвижной фазы); V d - объем матрицы сорбента без учета пор. Полный объем растворителя в колонке V t представляет собой сумму объемов подвижной и неподвижной фаз:
V t = V м + V i .
Удерживание молекул в эксклюзионной колонке определяется вероятностью их диффузии в поры и зависит главным образом от соотношения размеров молекул и пор. Коэффициент распределения К d , как и в других вариантах жидкостной хроматографии, представляет собой отношение концентраций вещества в неподвижной и подвижной фазах:
K d = C 1 /C 0
Так как подвижная и неподвижная фазы имеют одинаковый состав, то К d вещества, для которого обе фазы одинаково доступны, равен единице. Эта ситуация реализуется для молекул с самыми малыми размерами (в том числе и молекул растворителя), которые проникают во все поры, и поэтому движутся через колонку наиболее медленно. Их удерживаемый объем равен полному объему растворителя V t . Все молекулы, размер которых больше размера пор сорбента, не могут попасть в них (полная эксклюзия) и проходят по каналам между частицами. Они элюируются из колонки с одним и тем же удерживаемым объемом, равным объему подвижной фазы V м . Коэффициент распределения для этих молекул равен нулю.
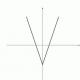
Принцип разделения и детектирования пробы в эксклюзионной хроматографии.
А - ввод образца; В - разделение по размерам; С - выход крупных макромолекул;
D - выход мелких макромолекул.

Связь между удерживаемым объемом и молекулярной массой (или размером молекул) образца описывается частной калибровочной кривой, т.е. каждый конкретный сорбент характеризуется своей калибровочной кривой, по которой оценивают область разделяемых на нем молекулярных масс. Точка А соответствует пределу эксклюзии, или мертвому объему колонки V м . Все молекулы, масса которых больше, чем в точке А, будут элюироваться одним пиком с удерживаемым объемом V м . Точка В отражает предел проникания, и все молекулы, масса которых меньше, чем в точке В, также будут выходить из колонки одним пиком с удерживаемым объемом V t . Между точками А и В располагается диапазон селективного разделения. Соответствующий ему объем
V i = V t - V м
принято называют рабочим объемом колонки. Отрезок CD представляет собой линейный участок частной калибровочной кривой, построенной в координатах V R - lg M . Этот участок описывается уравнением
V R = C 1 - C 2 lg M ,
где C 1 - отрезок, отсекаемый на оси ординат продолжением отрезка CD, С 2 - тангенс угла наклона этого отрезка к оси ординат. Beличину С 2 называют разделительной емкостью колонки, ее выражают числом миллилитров растворителя, приходящегося на один порядок изменения молекулярной массы. Чем больше разделительная емкость тем селективнее разделение в данном диапазоне масс. В нелинейных областях калибровочной кривой (участки АС и BD) в связи с уменьшением С 2 эффективность фракционирования заметно снижается. Кроме того, нелинейная связь между lg M и V R существенно усложняет обработку данных и снижает точность результатов. Поэтому стремятся выбирать колонку (или набор колонок) так, чтобы разделение анализируемого полимера протекало в пределах линейного участка калибровочной кривой.
Если какое-либо вещество элюируется с удерживаемым объемом больше V t , то это указывает на проявление других механизмов разделения (чаще всего адсорбционного). Адсорбционные эффекты обычно проявляются на жестких сорбентах, но иногда наблюдаются и на полужестких гелях, видимо, из-за повышенного сродства к матрице геля. Примером может служить адсорбция ароматических соединений на стиролдивинилбензольных гелях.
По-видимому, изменением параметров взаимодействия в системе полимер - сорбент - растворитель можно переходить от адсорбционного механизма к эксклюзионному и наоборот. В общем случае в эксклюзионной хроматографии стремятся полностью подавить адсорбционные и другие побочные эффекты, так как они, особенно при исследовании молекулярно-массового распределения (ММР) полимеров, могут существенно исказить результаты анализа. Одним из мешающих факторов является гидродинамический режим хроматографирования, в котором роль неподвижной фазы играют стенки колонки (канала) и разделение смеси макромолекул или частиц происходит вследствие различия скоростей протекания подвижпой фазы вдоль оси капала и у его стенок, а также за счет распределения разделяемых частиц по сечению канала в соответствии с их размером.
Принципиальными отличиями эксклюзионной хроматографии от других вариантов являются априори известная продолжительность анализа в конкретной используемой системе, возможность предсказания порядка элюирования компонентов по размеру их молекул, примерно одинаковая ширина пиков во всем диапазоне селективного разделения и уверенность в выходе всех компонентов пробы за достаточно короткий промежуток времени, соответствующий объему V t . Данный метод применяют преимущественно для исследования ММР полимеров и анализа макромолекул биологического происхождения (белки, нуклеиновые кислоты и т.д.), но указанные особенности делают его чрезвычайно перспективным для анализа низкомолекулярных примесей в полимерах и предварительного разделения проб неизвестного состава. Получаемая при этом информация существенно облегчает выбор наилучшего варианта ВЭЖХ для анализа данной пробы. Кроме того, микропрепаративное эксклюзионное разделение часто используют в качестве первого этапа при разделении сложных смесей путем комбинации различных видов ВЭЖХ.
В эксклюзионной хроматографии полимеров предъявляются наиболее жесткие требования к стабильности потока подвижной фазы. Точность результатов в эксклюзионной хроматографии полимеров заметно зависит от температуры. При ее изменении на 10°С ошибка определения средних молекулярных масс превышает ±10%. Поэтому в данном варианте ВЭЖХ обязательно термостатирование разделительной системы. Как правило, достаточна точность поддержания температуры ±1°С в пределах до 80-100°С. В некоторых случаях, например, при анализе полиэтилена и полипропилена, рабочая температура составляет 135-150°С. Наиболее распространенным детектором в эксклюзионной хроматографии полимеров является дифференциальный рефрактометр.
Выбор сорбентов, обеспечивающих оптимальные условия для решения конкретной аналитической задачи, проводят в несколько этапов. Матрица геля должна быть химически инертной, т.е. в ходе эксклюзионной хроматографии не должно происходить химическое связывание разделяемых макромолекул. При разделении белков, ферментов, нуклеиновых кислот при контакте с матрицей не должна происходить их денатурация. Первоначально на основе данных о химическом составе или растворимости анализируемых веществ устанавливают, какой вариант процесса следует применить - хроматографию в водных системах или в органических растворителях, что в значительной степени определяет тип необходимого сорбента. Разделение веществ низкой и средней полярности в органических растворителях можно успешно осуществить как на полужестких, так и на жестких гелях. Исследование ММР гидрофобных полимеров, содержащих полярные группы, чаще проводят на колонках со стиролдивинилбензольными гелями, так как в этом случае практически не проявляются адсорбционные эффекты и не требуется добавка модификаторов к подвижной фазе, что значительно упрощает подготовку и регенерацию растворителя.
Для работы в водных системах используют главным образом жесткие сорбенты; иногда очень хорошие результаты удается получить на полужестких гелях специальных типов. Затем по калибровочным кривым или данным о диапазоне фракционирования, выбирают сорбент нужной пористости с учетом имеющихся сведений о молекулярной массе образца. Если анализируемая смесь содержит вещества, отличающиеся по молекулярной массе не более чем на 2-2.5 порядка, то обычно удается разделить их на колонках с одним размером пор. При более широком диапазоне масс следует использовать наборы из нескольких колонок с сорбентами различной пористости. Ориентировочно калибровочную зависимость в этом случае получают сложением кривых для отдельных сорбентов.
Растворители, применяемые в эксклюзионной хроматографии, должны удовлетворять следующим основным требованиям:
1) полностью растворять образец при температуре разделения;
2) смачивать поверхность сорбента и не ухудшать эффективность колонки;
3) предотвращать адсорбцию (и другие взаимодействия) разделяемых веществ с поверхностью сорбента;
4) обеспечивать максимально высокую чувствительность детектирования;
5) иметь низкую вязкость и токсичность.
Кроме того, при анализе полимеров имеет существенное значение термодинамическое качество растворителя: весьма желательно, чтобы он был "хорошим" по отношению к разделяемому полимеру и матрице геля, т.е. были максимально выражены концентрационные эффекты.

Хроматограмма олигомеров полиэтиленгликоля, полученная на составной колонке 2(600х7.5) мм с TSK-гелем G2000PW, ПФ 0.05 М раствор NaCl, расход 1 мл/мин, давление 2 МПа, температура 40°С, рефрактометрический детектор.
Растворимость образца обычно является главным лимитирующим фактором, ограничивающим ассортимент пригодных подвижных фаз. Наилучшим органическим растворителем для эксклюзионной хроматографии синтетических полимеров по комплексу свойств является ТГФ. Он обладает уникальной растворяющей способностью, низкой вязкостью и токсичностью, лучше многих других растворителей совместим со стиролдивинилбензольными гелями и, как правило, обеспечивает высокую чувствительность детектирования при использовании рефрактометра или УФ-детектора в области до 220 нм. Для анализа высокополярных и нерастворимых в тетрагидрофуране полимеров (полиамиды, полиакрилонитрил, полиэтилентерефталат, полиуретаны и др.) обычно используют диметилформамид или μ-крезол, а разделение полимеров низкой полярности, например различных каучуков и полисилоксанов, часто проводят в толуоле или хлороформе. Последний является также одним из лучших растворителей при работе с ИК-детектором. о -Дихлорбензол и 1,2,4-трихлорбензол применяют для высокотемпературной хроматографии полиолефинов (обычно при 135 °С), которые в других условиях не растворяются. Эти растворители имеют очень высокий показатель преломления, поэтому иногда их целесообразно использовать вместо тетрагидрофурана для анализа полимеров с низким коэффициентом преломления, что позволяет повысить чувствительность при детектировании рефрактометром.
Для предотвращения окисления растворителей и полужестких гелей в условиях высокотемпературной эксклюзионной хроматографии к о -дихлорбензолу и 1,2,4-трихлорбензолу добавляют антиокислители (ионол, сантонокс R и др.).
Жесткие сорбенты совместимы с любыми подвижными фазами, имеющими рН<8-8.5. При более высоких значениях рН силикагель начинает растворяться и колонка необратимо теряет эффективность. Стиролдивинилбензольные гели совместимы в основном с элюентами умеренной полярности. Для работы на колонках с μ-стирогелем (от 1000Å и выше) пригодны тетрагидрофуран, ароматические и хлорированные углеводороды, гексан, циклогексан, диоксан, трифторэтанол, гексафторпропанол и диметилформамид.
Степень набухания частиц геля в различных растворителях неодинакова, поэтому замена элюента в колонках с данными сорбентами может привести к снижению эффективности за счет изменения объема геля и образования пустот. При использовании неподходящих растворителей (ацетон, спирты) происходит столь сильная усадка геля, что колонка оказывается безнадежно испорченной. У сорбентов с малым размером пор (типа μ-стирогеля 100Е и 500Е) такая усадка наблюдается как в полярных, так и в неполярных растворителях, поэтому с ними, кроме того, нельзя работать в насыщенных углеводородах, фторированных спиртах и диметилформамиде. Удобным, хотя и весьма дорогим выходом из положения является использование отдельных наборов колонок для каждого применяемого растворителя. Некоторые фирмы с этой целью выпускают колонки с одним и тем же размером пор, заполненные разными растворителями - тетрагидрофураном, толуолом, хлороформом и ДМФА.
При разделении макромолекул основной вклад в размывание полосы определяется затрудненной массопередачей. К сожалению, многие из применяемых элюентов имеют высокую вязкость. Для снижения вязкости (а также для улучшения растворимости) эксклюзионную хроматографию часто проводят при повышенных температурах, что существенно улучшает эффективность хроматографической системы.
Анализ большинства полимеров на жестких гелях часто осложняется их адсорбцией. Для подавления адсорбции обычно используют растворители, которые адсорбируются на насадке колонки сильнее, чем анализируемые вещества. Если по каким-либо причинам это невозможно, то подвижную фазу модифицируют добавкой 0.1-2% полярного модификатора, например тетрагидрофурана. Значительно более сильными модификаторами являются этиленгликоль и полигликоли с различной молекулярной массой (ПЭГ-200, ПЭГ-400, карбовакс 20 М). Иногда, например при анализе поликислот в диметилформамиде, требуется добавка достаточно сильных кислот. Следует отметить, что полностью устранить адсорбцию добавкой модификаторов удается не всегда. В таких случаях нужно использовать полужесткие гели. Некоторые полимеры хорошо растворяются только в высоко полярных растворителях (ацетон, диметилсульфоксид и т. п.), несовместимых со стиролдивинилбензольными гелями. При их разделении на жестких сорбентах выбор растворителя проводят в соответствии с общими принципами, изложенными выше.
Свои характерные особенности имеет эксклюзионная хроматография в водных средах. Из-за специфики многих разделяемых систем (белки, ферменты, полисахариды, полиэлектролиты и др.) и разнообразия применяемых сорбентов существует очень много вариаций состава ПФ для подавления различных нежелательных эффектов. В качестве сорбентов применяют декстрановые гели (сефадексы), полиакриламидные, оксиакрилметакрилатнык гели, гели агарозы и др. В процессе эксклюзионного хроматографирования поведение макромолекул определяется в первую очередь их гидродинамическими размерами, а характерной особенностью белков, ферментов и синтетических полиэлектролиты является зависимость размеров макромолекул от рН и ионной силы раствора. Чем меньше значение рН и ионной силы раствора, тем выгоднее становятся развернутые конформации макромолекул (так называемое полиэлектролитное набухание). В этом случае среднестатистические размеры растут, что приводит к уменьшению объемов удерживания в режиме эксклюзионной хроматографии. Общими приемами модификации является добавка различных солей и применение буферных растворов с определенным значением рН. В частности, поддержание рН<4 дает возможность подавить слабую ионообменную активность силикагелей, обусловленную присутствием на их поверхности кислых силанольных групп. Требуемая ионная сила подвижной фазы достигается при концентрации буферного раствора 0,05-0,6М; оптимальную концентрацию подбирают экспериментально. Для предотвращения ионообменной сорбции катионных соединений наиболее часто используют такой активный модификатор, как тетраметиламмонийфосфат при рН=3. Однако при разделении некоторых белков могут проявляться гидрофобные взаимодействия, в свою очередь осложняющие эксклюзионный механизм разделения. Те же эффекты иногда проявляются и при работе с дезактивированными гидрофильными сорбентами. Для их устранения к растворителю добавляют метанол. Иногда в водную подвижную фазу вводят полярные органические растворители, полигликоли, кислоты, основания и поверхностно-активные вещества.
Важнейшей областью применения эксклюзионной хроматографии является исследование высокомолекулярных соединений. Применительно к синтетическим полимерам этот метод за короткий срок занял главенствующее положение для определения их молекулярно-массовых характеристик и интенсивно используется для изучения других видов неоднородности. В химии биополимеров эксклюзионную хроматографию широко применяют для фракционирования макромолекул и определения их молекулярной массы.
Принципиальная черта эксклюзионной хроматографии высокомолекулярных синтетических полимеров заключается в невозможности разделения смеси на индивидуальные соединения. Эти вещества представляют собой смесь полимергомологов с различной степенью полимеризации и соответственно с разными молекулярными массами M i . Молекулярную массу таких смесей можно оценить некоторой средней величиной, которая зависит от способа усреднения. Содержание молекул каждой молекулярной массы M i определяют либо по их численной доле в общем числе полимерных молекул, либо по массовой доле в их общей массе. Обычно полимер характеризуют найденными этими способами средними величинами, которые называют соответственно среднечисленной M n и среднемассовой M w молекулярной массой. Значения M n дают, например, криоскопия, осмометрия, эбулиоскопия, а значениям M w - светорассеяние и ультрацентрифугирование.
Если обозначить число молекул с молекулярной массой M i через N i , то обшую массу полимера можно выразить через Σ M i N i , численную долю молекул с массой M i через N i / Σ N i , а массовую долю молекул с массой M i - через f i = M i N i / Σ M i N i . Чтобы определить часть общей массы полимера, соответствующую этим долям, их умножают на M i .
Просуммировав полученные значения для всех величин, получают средние молекулярные массы:
M n = Σ 1 /( f i /M i ) = (Σ M i N i )/(Σ N i )
M w = Σ M i f i = (Σ M i 2 N i )/(Σ M i N i )
Отношение M w > / M n характеризует полидисперсность полимера.
На практике молекулярную массу полимеров часто определяют методом вискозиметрии. Средневязкостную молекулярную массу находят по уравнению Марка - Куна - Хаувинка:
[η ] = K η / M η a
где [η ] - характеристическая вязкость; К η , а - константы для данной системы полимер - растворитель при данной температуре.
Величина M η описывается уравнением
M η = (Σ M i a f i ) 1/a
Как правило, величины средних молекулярных масс удовлетворяют неравенству
M w > M η > M n
Обычно полимерный образец характеризуют комплексом значений M w , M η , M n и M w /M η , но этого может быть недостаточно. Наиболее полную информацию о молекулярно-массовой неоднородности образца дают кривые ММР. Типичная хроматограмма, полученная в процессе эксклюзионного разделения, представляет собой достаточно плавную кривую с одним или несколькими максимумами. Из этой кривой с использованием калибровочной зависимости и соответствующих расчетов определяют значения средних молекулярных характеристик и ММР полимера в дифференциальной или интегральной форме.
Физические основы этого метода очень просты и наглядны. Исследуемый раствор полимера протекает через колонку, наполненную пористым сорбентом. Разделение смесей компонентов основано на распределении вещества между подвижной (текущий растворитель) и неподвижной (растворитель в порах сорбента) фазами, т. е. на разной способности макромолекул полимера проникать в поры гранул геля, откуда и произошло название метода .
Поверхность гранул сорбента покрыта множеством каналов, углублений и других неровностей, условно называемых порами, общий объем которых составляет V „. Объем, недоступный для растворителя, называют мертвым объемом. Пусть мимо такой поверхности протекает раствор, размеры которого соизмеримы с размерами пор или меньше их. Часть таких молекул проникает в поры, если их концентрация в движущейся фазе больше, чем в порах. Когда зона растворенного вещества покидает данный участок сорбента, концентрация молекул внутри пор геля становится больше, чем снаружи, и молекулы вновь диффундируют в поток подвижной фазы. Если же размер молекул больше размеров пор, то такая молекула проходит мимо гранулы геля, не задерживаясь, т. е. исключается (exclusion) из порового пространства. Таким образом, макромолекулы большего размера протекают через колонку быстрее. Это означает, что различные молекулы полидисперсного образца будут выходить из колонки в разное время при различном удерживаемом объеме VR
VR = V 0 + kvV „ >
Где Vo - объем подвижной фазы (текущий растворитель); Kv - коэффициент распределения пор по объему: для больших, полностью исключаемых из пор макромолекул kv = 0; для молекул растворителя kv= 1),
Значения Vr зависят главным образом от температуры, природы растворителя и концентрации раствора.
Поведение макромолекулы в растворе легко поддается детальному описанию, если определить ее энергию Гиббса AG . Если макромолекула попадает в пору, ее энтропия уменьшается. При наличии взаимодействия сегментов макромолекулы со стенками поры происходит изменение энтальпии: при притяжении энтальпия уменьшается, и наоборот. Поэтому при отсутствии адсорбции AG > 0, при сильной адсорбции макромолекул на стенках поры AG < 0. Соответственно в первом случае имеет место эксклюзионная хроматография (распределение по размерам), а во втором - адсорбционная; условия при AG =0 называются критическими. Поскольку в области AG > 0 происходит разделение макромолекул по размерам, возможен анализ по молекулярным массам линейных полимеров. Если полимер разветвленный, процесс разделения усложняется и зависит от типа и числа ответвлений, а в случае сополимеров - также и от состава, и блоч - ности цепи.
Наибольшее применение в качестве сорбента получили гели гидрофобных материалов, например полистирола, сшитого дивинил - бензолом: В таких гелях практически полностью отсутствуют эффекты адсорбции анализируемых проб. В последнее время широко распространены макропористые стекла, которые обладают по сравнению с полимерным сорбентом рядом преимуществ (жесткость частиц, варьирование размеров пор, химическая стабильность) и недостатков (повышенная сорбция на них полимеров).
Наиболее употребительными растворителями являются тетра - гидрофуран (ТГФ), хлороформ, толуол, циклогексан и их смеси. Предпочтение отдается ТГФ, который, в отличие от толуола, не образует мицелл или агрегатов с макромолекулами полимера и прозрачен в УФ - области спектра. Кроме того, эффективность метода 11IX при использовании ТГФ максимальна при довольно низких температурах (35-45 °С). Однако при длительном хранении ТГФ окисляетея с образованием взрывоопасных пероксидных соединений, поэтому необходимо проводить его предварительную очистку. Используя ТГФ в качестве растворителя, можно анализировать каучуки всех марок, а также термоэластопласты. При проведении анализа бутадиен - нитрильного каучука целесообразно использовать смесь растворителей, один из которых имеет сродство к неполярному звену каучука, а другой - к полярному . Если используется рефрактометрический детектор, необходимым требованием к растворителю является разность показателей преломления растворителя и полимера.
Впервые прибор для гель-хроматографического анализа поли Меров выпущен фирмой "Waters" в 1964 году, спустя пять лет после Открытия метода. Сегодня жидкостные хроматографы для анализа Молекулярно-массового распределения (ММР) полимеров выпускаются во всех промышленно развитых странах, в России известны хроматографы серии ХЖ. К числу последних модификаций зарубежных приборов относится гель-хроматограф фирмы "Waters Chem. Div." с вискозиметром для определения молекулярной массы, ММР, а также степени ориентации макромолекул. Карусельная конструкция прибора позволяет одновременно испытывать 16 образцов.
Блок-схема хроматографа включает: О Блок дегазатора - служит для удаления газов из растворителя и способствует поддержанию одинакового количества растворителя в течение продолжительного времени.
О Блок дозатора - позволяет вовремя вводить пробу заданного объема и работать в автоматическом режиме,
О В современных жидкостных хроматографах пересчет хромато - граммы в ММР полимера, включая калибровку прибора по молекулярной массе и коррекцию на приборное уширение, осуществляется с помощью ЭВМ. Это позволяет по принятым программам рассчитывать дифференциальную и интегральную ММР и усредненные значения молекулярной массы. Специальные микропроцессоры управляют работой блоков прибора по заданной программе.
Пример записи условий эксперимента, проводимого методом гельпроникающей хроматографии. Установка состоит из следующих основных элементов; насос модели 6000А, дозатор проб U 6К и дифференциальный рефрактометр R 401. В установку входят также 3 разделительные колонки ^каждая длиной 300 мм и с внутренним диаметром 8 мм. Колонки заполнены SDV-Gel 5, который имеет диаметр пор 103, 104 и 105 A (Polymer-Standard-Service, PSS, Mainz). Температура исследования составляет 22°С и скорость пропускания 1,0 мл/мин. В качестве растворителя используется тетрагидрофуран, объём впрыска 100 мкл при концентрации пробы 6-10 г/л. Универсальная калибровка производится по полистиролу с молекулярной массой 104- 106 г/моль.
ГПХ позволяет изучить тонкие изменения в химической структуре полимеров и определить полное ММР, а потому широко используется в химии полимеров . В промышленном производстве эластомеров метод ГПХ может быть применен для оперативного контроля качества серийно выпускаемой продукции и соответствующей корректировки технологического процесса, а также при разработке и совершенствовании получения эластомеров с заданными свойствами . Гель-хроматографы можно включать в автоматизированные системы управления технологическими процессами с отбором проб на анализ непосредственно из реактора. Длительность анализа, включая подготовку пробы, составляет 20-30 минут.
5. Гель-хроматография
Гель-фильтрация (синоним гель-хроматография) - метод разделения смеси веществ с различными молекулярными массами путем фильтрации через различные так называемые ячеистые гели.
Неподвижной фазой в гель-хроматографии является растворитель, находящийся в порах геля, а подвижной – сам растворитель, т.е и подвижную и неподвижную фазы составляет одно и тоже вещество или одна и та же смесь вещества. Гель готовят на основе, например, декстрана, полиакриламида или других природных и синтетических соединений.
В отличии от других хроматографических методов, использующих различия в химических свойствах разделяемых веществ, проявляющихся при их распределении между стационарной и подвижной фазами, разделение основано на ситовом эффекте, характерном для гелей с определенным радиусом пор. Растворитель (подвижная фаза) заполняет как внешний объем между зернами геля, так и внутренний объем пор. Объем растворителя между зернами геля – V м называют промежуточным, транспортным или мертвым объемом, а внутренний объем пор – V п рассматривается как объект стационарной фазы. Когда в колонку вводят пробу, содержащую несколько типов ионов или молекул с разными размерами, то они стремятся из подвижной фазы проникнуть внутрь пор. Такое проникновение обусловлено энтропийным распределением, поскольку концентрация молекул разделяемых веществ в наружном растворе оказывается выше, чем в поровом пространстве. Но оно становится возможным только в том случае, если размеры ионов или молекул меньше диаметра пор.
Рис 5 Общий вид градуировочной кривой в гель-хроматографии:
1 – область исключения, где все молекулы имеют размер больше m 2 ;
2 – область проникновения или разделения, где размеры молекул лежат в интервале от m 1 и m 2 ;
3 - область, где происходит полное проникновение молекул с размерами менее m 1.
В процессе гель-хроматографирования могут быть отделены крупные молекулы, которые гелем не сорбируются, так как их размеры превышают размеры пор, от мелких, которые проникают в поры, а затем могут быть элюированы. Проводятся и более тонкие разделения, так как размеры пор можно регулировать, изменяя, например, состав растворителя и, как следствие, набухаемость геля. Гель-хроматография может быть выполнена в колоночном варианте и в тонкослойном.
Применяемые на практике гели обычно подразделяют на мягкие, полужесткие и жесткие. Мягкими гелями являются высокомолекулярные органические соединения с незначительным числом поперечных связей. Фактор емкости, равный отношению объема растворителя внутри геля к его объему вне геля, у них равен 3. При набухании они значительно увеличивают собственный объем. Это сефадексы или декстрановые гели, агарочные гели, крахмал и др. Они применяются для разделения смесей низкомолекулярных веществ, часто в тонкослойном варианте. Хроматографирование на мягких гелях называют гель - фильтрацией.
Полужесткие гели получают путем полимеризации. Большое распространение получили стирогели - продукты сополимеризации стирола и дивинилбензола с большим числом поперечных связей. Фактор емкости полужестких гелей лежит в пределах 0,8...1,2, их объем при набухании увеличивается не очень значительно (в 1,2...1,8 раза). Хроматографирование на полужестких гелях называют гель-проникающей хроматографией.
К жестким гелям относят силикагели и часто пористые стекла, хотя они и не являются гелями. Жесткие гели имеют небольшой фактор емкости (0,8...1,1) и фиксированный размер пор. Эти материалы используют в гель-хроматографии при высоком давлении.
Растворители гель-хроматографии должны растворять все компоненты смеси, смачивать поверхность геля и не адсорбироваться на ней.
Практическое применение гель-хроматографии связано, главным образом, с разделением смеси высокомолекулярных соединений, хотя нередко они используются для разделения и низкомолекулярных, так как разделение этим методом возможно при комнатной температуре.
6. Высокоэффективная жидкостная хроматография (ВЖКХ)
Высокоэффективная жидкостная хроматография – наиболее эффективный метод анализа органических проб сложного состава. Процесс анализа пробы делится на 2 этапа:
· разделение пробы на составляющие компоненты;
· детектирование и измерение содержания каждого компонента.

Задача разделения решается при помощи хроматографической колонки, которая представляет собой трубку, заполненную сорбентом. При проведении анализа через хроматографическую колонку подают жидкость (элюент) определенного состава с постоянной скоростью. В этот поток вводят точно отмеренную дозу пробы.
Компоненты пробы, введенной в хроматографическую колонку, из-за их разного сродства к сорбенту колонки двигаются по ней с различными скоростями и достигают детектора последовательно в разные моменты времени.
Таким образом, хроматографическая колонка отвечает за селективность и эффективность разделения компонентов. Подбирая различные типы колонок можно управлять степенью разделения анализируемых веществ. Идентификация соединений осуществляется по их времени удерживания. Количественное определение каждого из компонентов рассчитывают, исходя из величины аналитического сигнала, измеренного с помощью детектора, подключенного к выходу хроматографической колонки.
При анализе соединений с низкими ПДК (биогенные амины, полиароматические углеводороды, гормоны, токсины) из-за трудоемкости подготовки реальных проб особенно важной характеристикой становится чувствительность и селективность метода. Применение флуориметрического детектора позволяет не только снизить пределы обнаружения, но и селективно выделить анализируемые вещества на фоне матричных и сопутствующих компонентов пробы.
Метод ВЭЖХ применяется в санитарно-гигиенических исследованиях, экологии, медицине, фармацевтике, нефтехимии, криминалистике, для контроля качества и сертификации продукции.
В качестве блока подачи элюента используется насос "Питон" шприцевого типа, который имеет следующие особенности:
· отсутствие пульсаций давления при подаче растворителя;
· большой диапазон объемных скоростей потока;
· большой объем камеры насоса;
· расширяемость (возможность сочетать несколько блоков для создания градиентной системы).
В хроматографической системе могут использоваться различные типы детекторов, например, "Флюорат-02-2М" (спектральная селекция осуществляется фильтрами) или "Флюорат-02 Панорама" (спектральная селекция осуществляется монохроматорами).

7. Применение
Жидкостная хроматография важнейший физико-химический метод исследования в химии, биологии, биохимии, медицине, биотехнологии. Ее используют для анализа, разделения, очистки и выделения аминокислот, пептидов, белков, ферментов, вирусов, нуклеотидов, нуклеиновых кислот, углеводов, липидов, гормонов и т. д.; изучения процессов метаболизма в живых организмах лекарственных препаратов; диагностики в медицине; анализа продуктов химического и нефтехимического синтеза, полупродуктов, красителей, топлив, смазок, нефтей, сточных вод; изучения изотерм сорбции из раствора, кинетики и селективности хим. процессов.
В химии высокомолекулярных соединений и в производстве полимеров с помощью жидкостной хроматографии анализируют качество мономеров, изучают молекулярно-массовое распределение и распределение по типам функциональности олигомеров и полимеров, что необходимо для контроля продукции. Жидкостную хроматографию используют также в парфюмерии, пищевой промышленности, для анализа загрязнений окружающей среды, в криминалистике.
Заключение
Начало ХХ века ознаменовалось открытием хроматографического метода анализа, обогатившего и объединившего различные области науки, без которых немыслим научный прогресс XXI века. Внедрение хроматографических методов, и в первую очередь жидкостной хроматографии, в медицину позволило решить многие жизненно важные проблемы: исследование степени чистоты и стабильности лекарственных средств, препаративное выделение индивидуальных гормональных препаратов (например, инсулина, интерферона), количественное определение в биологических объектах нейромедиаторов: адреналина, норадреналина. С наличием этих веществ в живом организме связывают способность к запоминанию, обучению, приобретению каких-либо навыков. Идентификация методами ВЭЖХ стероидов, аминокислот, аминов и других соединений оказалась крайне важной при диагностике некоторых наследственных заболеваний: инфаркта миокарда, диабета, различных заболеваний нервной системы. Одной из актуальных задач клинической медицины для экспресс-диагностики является проведение так называемого профильного анализа компонентов биологического объекта, осуществляемого методами жидкостной хроматографии, что позволяет не проводить идентификацию каждого пика, а сопоставлять профили хроматограмм для заключения о норме или патологии. Обработка огромного массива информации осуществляется только с использованием ЭВМ (метод получил название "метод распознавания образов").
Список литературы
1. Васильев В. П. Аналитическая химия, В 2 кн. Кн. 2 Физико-химические методы анализа: Учеб. для студ. вузов, обучающихся по химико-технол. спец. – 4-е изд., стереотип. – М.: Дрофа, 2004 – 384 с.
2. Москвин Л.Н., Царицына Л.Г. Методы разделения и концентрирования в аналитической химии. – Л.: Химия, 1991. – 256 с.
3. http://bibliofond.ru/view.aspx?id=43468
4. http://ru.wikipedia.org/wiki/Бумажная_хроматография
5. http://referats.qip.ru/referats/preview/93743/6
6. http://www.curemed.ru/medarticle/articles/12186.htm
7. http://www.lumex.ru/method.php?id=16
8. http://www.xumuk.ru/encyklopedia/1544.html
9. http://www.pereplet.ru/obrazovanie/stsoros/1110.html
Описание
Совместно с немецкой компанией Polymer Standards Service (PSS) — одним из ведущих производителей материалов и оборудования для гель-проникающей хроматографии (ГПХ, GPC) или, по-другому, эксклюзионной хроматографии (SEC) — мы предлагаем комплексные решения для определения средних значений молекулярной массы полимеров (природных, синтетических, биополимеров), молекулярно-массового распределения и характеристик полимерных макромолекул в растворе. В данном методе разделение аналита происходит не за счет адсорбционных взаимодействий с неподвижной фазой, а исключительно по величине гидродинамического радиуса макромолекул.
Для детектирования разделенных по молекулярной массе компонентов всегда используется как минимум один концентрационный детектор (традиционные для ВЭЖХ рефрактометрический и спектрофотометрический , детектор по испарительному светорассеянию), а также специальные детекторы для анализа полимеров: вискозиметрический , детектор по лазерному светорассеянию . В сочетании с концентрационным данные детекторы позволяют определять абсолютную молекулярную массу, конформацию макромолекул в растворе, радиус инерции, гидродинамический радиус, степень разветвленности, константы уравнения Марка-Куна-Хаувинка, вириальные коэффициенты. При наличии калибровочных зависимостей данная система позволяет получить исчерпывающую информацию о макромолекулярных объектах и их поведении в растворах всего за один анализ (~15 мин), в то время как оценка данных характеристик традиционными методами составляет несколько дней.
Для обработки результатов измерений необходимо использовать специальное программное обеспечение. Мы предлагаем гибкие модульные ВЭЖХ системы для гель-проникающей хроматографии (GPC), включающие модули Prominence (насосы , термостат колонок , автодозаторы , рефрактометрический детектор) и специфические модули от компании Polymer Standards Service (PSS) — авторитетного эксперта в области ВЭЖХ анализа полимеров. Для расчетов результатов анализа возможно использование как программного обеспечения Shimadzu GPC Option, интегрированного в стандартную программу LabSolution LC, так и использование программных продуктов PSS — WinGPC SW, поддерживающих специальные детекторы.
Для работы с агрессивными по отношению к традиционно используемых капиллярам и фитингам подвижными фазами (гексафторизопропанол, тетрагидрофуран) возможна комплектация ВЭЖХ систем специальным дегазатором, насосами и автодозатором, компоненты которых устойчивы к указанным растворителям.
Базовые системы для ГПХ
Базовая ВЭЖХ система для ГПХ
Базовая ВЭЖХ система для ГПХ может быть сконфигурирована на базе блоков модели LC-20 Prominence с одним из концентрационных детекторов (спектрофотометрический/диодная матрица SPD-20A/SPD-M20A для поглощающих УФ-излучение полимеров, универсальными рефрактометрическим RID-20A и детектором испарительного светорассеяния ELSD-LT II). Данная система, при наличии подходящих стандартов и калибровочных зависимостей, позволяет определять величину относительной молекулярной массы полимеров, а также оценивать гидродинамические размеры макромолекул в растворе.
| Насос LC-20AD | |
|---|---|
| Тип насоса | Двойной параллельный микроплунжерный механизм |
| Ёмкость камер плунжера | 10 мкл |
| Диапазон скорости потока элюента | 0,0001 - 10 мл/мин |
| Максимальное давление | 40 МПа |
| Точность установки потока | 1% или 0,5 мкл (в зависимости от того, что лучше) |
| Пульсация | 0,1 МПа (для воды при 1,0 мл/мин и 7 МПа) |
| Режим работы | постоянный поток, постоянное давление |
| Насосы можно укомплектовать дополнительным устройством для автоматической промывки плунжера. Насосы оборудованы датчиком течи. Материал плунжера насоса — стойкий к агрессивным средам (сапфир). | |
| Рефрактометрический детектор RID-20A | |
| Источник излучения | Вольфрамовая лампа, время работы 20000 час |
| Диапазон показателя преломления (RIU) | 1,00 - 1,75 |
| Термостатирование оптического блока | 30 - 60С° с двойным контролем температуры оптической системы |
| Рабочий диапазон скоростей потока | Возможность работы в широком диапазоне использования (от аналитического режима до препаративной хроматографии) без замены измерительной ячейки: от 0,0001 до 20 мл/мин в аналитическом режиме; до 150 мл/мин в препаративном режиме |
| Шум | 2,5×10 -9 RIU |
| Дрейф | 1×7 -7 RIU/час |
| Диапазон линейности | 0,01-500×10 -6 в аналитическом режиме 1,0-5000×10 -6 в препаративном режиме |
| Переключатель потоковых линий | соленоидный вентиль |
| Макс. рабочее давление | 2 МПа (20 кгс/см²) |
| Объем ячейки | 9 мкл |
| Настройка нуля | оптический баланс (оптический ноль); авто-ноль, тонкая настройка нуля сдвигом базовой линии |
| Термостат колонок с принудительной конвекцией воздуха СТО-20А | |
| Диапазон контролируемых температур | от 10C° выше комнатной до 85C° |
| Точность контроля температуры | 0,1C° |
| Внутренний объем термостата | 220×365×95 мм (7,6 л) |
| Вместимость термостата | 6 колонок; кроме колонок могут быть установлены 2 ручных инжектора, градиентный смеситель, два переключающих крана высокого давления (6-ти или 7-ми портовых), кондуктометрическая ячейка |
| Возможности | линейное программирование температуры; отслеживание и сохранение в файл изменений параметров колонки, количества анализов, количества прошедшей подвижной фазы (при установке опционного устройства CMD) |
| Контроль рабочих параметров | датчик утечки растворителя; система защиты от перегрева |
Детектор светорассеяния
Детектор многоуглового светорассеяния SLD7100 MALLS (PSS)

Детектор многоуглового светорассеяния SLD7100 MALLS (PSS) позволяет производить измерения статического светорассеяния одновременно под семью углами (35, 50, 75, 90, 105, 130, 145°) и определять абсолютные величины молекулярных масс, истинные параметры молекулярно-массового распределения, оценивать размеры и конформацию макромолекул в растворе . Данный детектор устраняет необходимость использования каких-либо стандартов, а также может служить в качестве емкостного инструмента (без ВЭЖХ системы) без каких-либо дополнительных модификаций.
Вискозиметрический детектор (PSS, Германия)
Вискозиметрический детектор DVD1260 (PSS)

Вискозиметрический детектор DVD1260 (PSS) при использовании в составе ВЭЖХ системы LC-20 Prominence позволяет определять средние молекулярные массы и параметры молекулярно-массового распределения , используя метод универсальной калибровки, незаменимый для макромолекул со сложной и глобулярной архитектурой, а также характеристическую вязкость, константы уравнения Марка-Куна-Хаувинка, степень разветвления, вириальные коэффициенты и конформацию макромолекул в растворе , исходя из определенных моделей, уже заложенных в программное обеспечение. Уникальная измерительная ячейка детектора представляет собой четырехплечевой асимметричный капиллярный мост, не содержащий, в отличие от всех имеющихся на рынке аналогов, ячеек запаздывания (hold-up columns) — в сравнительном контуре встроен специальный разбавительный резервуар, что позволяет сократить время анализа по крайней мере вдвое и избежать появления отрицательных системных пиков. Погрешность поддержания температуры в ячейке составляет менее 0,01 °C , что является первоочередным критичным фактором в вискозиметрическом анализе.
| Питание | От 110 до 260 В; 50/60 Гц; 100 ВА |
|---|---|
| Диапазон разницы давлений (DP) | -0,6 кПа — 10,0 кПа |
| Диапазон давления на входе (IP) | 0-150 кПа |
| Объем измерительной ячейки | 15 мкл |
| Разбавительный компенсационный объем (резервуар) | 70 мл |
| Скорость сдвига (1,0 мл/мин) | < 2700 с -1 |
| Уровень шума | 0,2 Па, сигнал разности давлений, 5 °С |
| Аналоговый выход | 1,0 В / 10 кПа FSD разность давлений 1,0 В / 200 кПа FSD давление на входе |
| Общий объем детектора | Около 72 мл (включая резервуар) |
| Макс. скорость потока | 1,5 мл/мин |
| Точность задания температуры | ±0,5 °C |
| Стабильность температуры | Не хуже 0,01 °C |
| Цифровой интерфейс | RS-232C, USB, Ethernet |
| Скорость передачи данных (бод) | 1200 - 115200 |
| Цифровые входы | Промывка, Обнуление, Инжекция, Ошибка |
| Цифровые выходы | Инжекция, Ошибка |
| Масса | Около 4 кг |
| Размеры (Ш, В, Г) | 160×175×640 мм |
Аксессуары

Для работы в режиме ГПХ и построения калибровочных зависимостей мы предлагаем широкий выбор колонок для ГПХ, заполненных гелями (неподвижная фаза) и элюентами самой разной химической природы (полярных и неполярных), предназначенных для анализа как высокомолекулярных полимеров, так и олигомеров, а также стандартных полимерных объектов .
Колонки для гель-проникающей хроматографии (GPC, SEC):
- для любых органических элюентов: PSS SDV, GRAM, PFG, POLEFIN (до 200 °C);
- для водных элюентов: PSS SUPREMA, NOVEMA, MCX PROTEEMA;
- колонки с монодисперсным распределением пор по размерам либо смешанного типа для получения абсолютно линейных калибровок;
- для определения низких и высоких значений ММ;
- готовые наборы колонок для расширения диапазона определяемых молекулярных масс;
- для синтетических и биополимеров;
- решения от микро ГПХ до препаративных систем;
- колонки для быстрых разделений.
Колонки могут поставляться в любом выбранном вами элюенте.
Стандарты для гель-проникающей хроматографии (GPC, SEC):
- индивидуальные стандартные образцы и готовые наборы стандартов;
- растворимые в органических растворителях:
- полистирол
- поли(α-метилстирол)
- полиметилметакрилат
- поли(н-бутилметакрилат)
- поли(трет-бутилметакрилат)
- полибутадиен-1,4
- полиизопрен-1,4
- полиэтилен
- поли(2-винилпиридин)
- полидиметилсилоксан
- полиэтилентерефталат
- полиизобутилен
- полилактид
- растворимые в водных системах:
- декстран
- пуллулан
- гидроксиэтилированный крахмал
- полиэтиленгликоли и полиэтиленоксиды
- Na-соль полиметакриловой кислоты
- Na-соль полиакриловой кислоты
- Na-соль поли(п-стиролсульфокислоты)
- Поливиниловый спирт
- протеины
- MALDI стандарты, наборы для валидации детекторов по светорассеянию (LSD) и вискозиметрии;
- дейтерированные полимеры;
- полимеры и стандарты, изготавливаемые под заказ.
В данном методе анализируемый раствор пропускают через колонку, заполненную набухшим гранулированным гелем (неподвижная фаза). Частицы геля состоят из высокомолекулярного соединения (ВМС), имеющего сетчатое строение (гибкие макромолекулы сшиты поперечными химическими связями). По этой причине набухший гель имеет сетчатую структуру, между узлами которой находится растворитель.
Распределение межузельного пространства геля по радиусам - основная характеристика применяемого геля, она зависит от природы полимера и растворителя, частоты сетки и температуры.
Эффект разделения веществ в случае применения гель- хроматографии обусловлен тем, что молекулы, отличающиеся по молярной массе (длине), способны проникать в структуру геля на разную глубину и удерживаться в ней различное время. Поэтому при- элюировании из колонки в первую очередь выходят крупные молекулы, не способные проникнуть вглубь гранул геля, а в последнюю - самые мелкие. Происходит как бы просеивание молекул через межузельное пространство геля.
Хроматографию осуществляют следующим образом. Гранулы геля помещают в стеклянную колонку, дают им набухнуть в растворителе и далее в колонку подают анализируемую смесь веществ. Небольшие молекулы равномерно распределяются по всему объему гранул, в то время как более крупные молекулы, будучи не в состоянии проникнуть внутрь, остаются только в окружающем гранулы слое растворителя (внешнем объеме). Далее колонку промывают растворителем - элюентом. Как уже отмечалось, крупные молекулы перемещаются по колонке с большей скоростью, чем мелкие, движение которых постоянно замедляется диффузией вглубь гранул неподвижной фазы. В итоге компоненты смеси элюируются из колонки в порядке уменьшения их молярной массы. Пробы (фракции) выходящего из колонки элюента отбирают на анализ. Проведение эксперимента значительно упрощается, если имеется возможность непрерывного автоматического анализа элюента.
Для исследования гель нужно выбирать таким, чтобы его сродство к анализируемым веществам было минимальным: в этом случае вещества способны свободно перемешаться вдоль слоя колонки в соответствии с размером их молекул. Гранулы геля должны иметь оптимальные размеры: слишком мелкие - способствуют быстрому установлению диффузионного равновесия, но вызывают высокое гидравлическое сопротивление колонки. Применение крупных гранул дает низкое гидравлическое сопротивление, но тормозит диффузию, увеличивая время выхода анализируемых веществ.
Кроме того, гранулы должны обладать определенной механической прочностью, иначе их деформация в колонке приведет к падению скорости элюирования.
Наиболее широкое распространение для гель-хроматографии получил сефадекс (гель декстрана - высокомолекулярного полисахарида), образующийся при выращивании определенных бактерий в среде сахарозы. Выпускается восемь типов сефадекса, различающихся по степени их набухания, он устойчив к щелочам и слабым кислотам.
Рассмотрим конкретный пример разделения смеси крахмала и глюкозы на сефадексе G- 25. В колонку с 87 г геля поместили 2 см 3 водного раствора крахмала и глюкозы и элюировали смесь раствором поваренной соли. Фракции фильтрата собрали и определили в них содержание крахмала и глюкозы. Молекулы крахмала практически не проникали внутрь гранул геля, поэтому крахмал элюировался первым при расходе элюента 32-44 мл, а глюкоза - второй при расходе элюента 66-80 мл.
По полученным данным построили хроматограмму. Для этого по оси ординат отложили концентрацию веществ во фракциях, а по оси абсцисс - объем элюента (или номер фракции). Из хроматограммы определили объемы удерживания веществ V/ - общий объем собранного элюента до момента выхода из колонки фракции с максимальной концентрацией вещества. Из конкретной колонки данное вещество элюируется всегда при одном и том же V,. В рассматриваемом случае объем удерживания для крахмала оказался равным 35 мл, а для глюкозы - 73 мл.
Объем удерживания веществ воспроизводится достаточно точно. Поэтому с помощью гель-хроматографии можно решать и обратную задачу - определять молярную массу неизвестных соединений, определив их V,. Для этого колонку сначала калибруют: определяют объемы удерживания ВМС (стандартных полимеров) с известной молярной массой. С этой целью для калибровки гидрофильных гелей чаще всего применяют белки, обладающие известной фиксированной молярной массой. Кроме того, для ряда глобулярных белков, помимо молярной массы, определенной химическим путем, известен также и размер их молекул. Таким образом, с помощью колонки, калиброванной известными белками, можно получить представление и об эффективном радиусе исследуемых молекул.